Vera Vorstandlechner erhält Theodor-Billroth-Preis der Österreichischen Gesellschaft für Chirurgie

(Wien, 12-07-2022) Vera Vorstandlechner von der Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie der MedUni Wien wurde von der Österreichischen Gesellschaft für Chirurgie mit dem Theodor-Billroth-Preis für ihre Forschungsarbeit ausgezeichnet, die sich mit der genetischen Landkarte hypertropher Narben und der Identifikation neuer Therapie-Ansätze beschäftigt.
Die Studie, die die Fachjury überzeugte, wurde im Oktober 2021 unter dem Titel „The serine proteases dipeptidyl-peptidase 4 and urokinase are key molecules in human and mouse scar formation“ in Nature Communications (https://doi.org/10.1038/s41467-021-26495-2) publiziert. Vera Vorstandlechner und ihre Forschungskolleg:innen untersuchten dafür das genetische Muster von hypotrophen Narben und mögliche Ansatzpunkte für neue Behandlungsmethoden. Diese entwickeln verdickte, oft schmerzhafte und juckende Narbenstränge und stellen nach Unfällen, Operationen und besonders nach Verbrennungsverletzungen eine schwere Belastung für Patient:innen dar. Um deren genetische Landkarte und die Narbenreife in einem Mausmodell zu analysieren, verwendete das Forschungsteam die Methode der Einzelzellsequenzierung. In der menschlichen Haut wurde damit ein Subtyp von Fibroblasten identifiziert, der signifikant mit hypertropher Narbenbildung assoziiert ist. Der Vergleich dieses narbenspezifischen Fibroblastentyps mit Fibroblasten während der Narbenreifung in Mäusen identifizierte eine Gruppe von Serinproteasen, die in beiden experimentellen Ansätzen gleichermaßen erhöht waren.
In weiterer Folge wurde eine mögliche anti-fibrotische Wirkung von zwei Inhibitoren von Serinproteasen (Sitagliptin und BC-11) auf ihren therapeutischen Nutzen hin untersucht. Es konnte gezeigt werden, dass die Zugabe beider Inhibitoren zu Fibroblastenkulturen die Freisetzung von Komponenten der extrazellulären Matrix (Kollagene und Fibronektin) und die Kontraktilität der Fibroblasten verringern konnte. In einem Maus-Wundmodell zeigte die topische Anwendung der Inhibitoren eine verbesserte Narbenqualität, eine verringerte Parallelität von Kollagenfasern, eine verringerte Akkumulation von extrazellulären Matrixproteinen bei vergleichbar guter Wundheilung. Die Studie liefert damit völlig neue Einblicke in die Genaktivität im Narbengewebe und zeigt neue Wirkstoffe zur Behandlung hypertropher Narben auf.
Zur Person
Vera Vorstandlechner studierte 2011 bis 2017 Medizin in Wien und absolviert ihr PhD-Studium bei Hendrik Jan Ankersmit (Universitätsklinik für Thoraxchirurgie der MedUni Wien). Seit 2020 ist sie Assistenzärztin an der Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie. Gemeinsam mit Michael Mildner von der Universitätsklinik für Dermatologie und mit dem Ankersmit-Labor der Universitätsklinik für Thoraxchirurgie forscht sie an der Entstehung und Therapie von Narben. Sie wurde bereits mit Vortragspreisen und Stipendien ausgezeichnet, sowie zum „Researcher of the Month Februar 2022“ ernannt.

(Wien, 11-07-2022) Paul Supper, PhD-Student der MedUni Wien und Assistenzarzt an der Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie der MedUni Wien, wurde am 63. Österreichischen Chirurgenkongress mit dem Young Surgeons Award ausgezeichnet.
Supper erhielt den Preis für die Studie „Multimodale Analyse der Muskelregeneration mittels Deep-Learning-Bildgebung – ein Proof of Principle in experimenteller peripherer Nervenverletzung“. Die Studie wird in Kooperation mit der Universitätsklinik für Radiologie und Nuklearmedizin sowie dem Zentrum für Medizinische Physik und biomedizinische Technik durchgeführt. Sie untersucht die Entwicklung des Muskelvolumens und Glukosestoffwechsels als funktionellen Marker der peripheren Nervenregeneration mithilfe von Computertomographie, Positrons-Emissions-Tomographie und einen Deep-Learning Algorithmus. Die frühe Erkennung der einsetzenden oder fehlenden Muskelregeneration vor ersten klinischen Anzeichen, könnte die Entscheidung über eine Operation unterstützen und den Patient:innen somit eine frühzeitige und zielgerichtete Therapie ermöglichen.
Zur Person
Paul Supper studierte Medizin an der MedUni Wien und arbeitet derzeit als Assistenzarzt an Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie der MedUni Wien. Er ist Doktorand im PhD-Programm Neuroscience und Mitglied der Arbeitsgruppe von Christine Radtke. Paul Supper engagiert sich in der Lehre und ist Koordinator des Distance Learnings im 5. Studienjahr.
MedUni Wien RESEARCHER OF THE MONTH, Februar 2022

Die Jury „Researcher of the Month” verleiht die Auszeichnung für diesen Monat Frau Dr.in Vera Vorstandlechner aus Anlass der im Top-Journal „Nature Communications“ (IF 14.9) erschienenen Arbeit „The serine proteases dipeptidyl-peptidase 4 and urokinase are key molecules in human and mouse scar formation“ (1). Die multidisziplinäre Studie entstand im Rahmen des PhD-Studiums von Dr.in Vorstandlechner in der Arbeitsgruppe von Univ.-Prof. Dr. Hendrik-Jan Ankersmit vom Forschungslabor für Thoraxchirurgie und angewandte Immunologie in Zusammenarbeit mit der Arbeitsgruppe von Assoc. Prof. Dr. Michael Mildner von der Universitätsklinik für Dermatologie.
Hypertrophe Narbenbildung: ein unterschätztes Problem
Hypertrophe Narben mit verdickten, oft schmerzhaften und juckenden Narbensträngen sind nach Unfällen, Operationen und besonders nach Verbrennungsverletzungen eine schwere Belastung für PatientInnen. Obwohl verschiedene, leider oft unbefriedigende Therapiekonzepte zur Verfügung stehen, sind bis jetzt keine Wirkstoffe bekannt, die hypertrophe Narben schon während ihrer Bildung verbessern oder verhindern können.
Die genetische Landkarte von hypertrophen Narben
Mittels Einzelzellsequenzierung haben die ForscherInnen in dieser Studie sowohl das Genmuster ausgereifter humaner hypertropher Narben als auch der Narbenreifung im Mausmodell, analysiert. Dabei wurde in humaner Haut ein bestimmter Subtyp von Fibroblasten identifiziert, der maßgeblich an der Narbenentwicklung beteiligt war. Der Vergleich dieses Narben-spezifischen Fibroblasten-Typs mit Fibroblasten im Zuge der Narbenreifung in Mäusen führte zur Identifikation von einer Gruppe von Serinproteasen, die in beiden experimentellen Ansätzen gleichermaßen erhöht waren.
Zwei neue Therapieansätze in der Narbenbildung
Die Hemmung von Dipeptidyl-Peptidase IV (DPP4) mit dem Wirkstoff Sitagliptin und von Urokinase (PLAU) mit BC-11 verhinderten in vitro die Bildung von Myofibroblasten, welche in Narben und anderen fibrosierenden Pathologien für Kontraktion und übermäßige Matrix-Deposition verantwortlich sind. Die Zugabe von Sitagliptin und BC-11 zu Fibroblastenkulturen reduzierte dabei deutlich die Ausschüttung von Matrix-Komponenten wie Kollagen und Fibronektin und verringerte die Kontraktilität der Fibroblasten. Im Maus-Wundmodell zeigte sich durch die topische Anwendung der Inhibitoren, bei gleich guter Wundheilung, eine Verbesserung der Narbenqualität mit verringerter Parallelität der Kollagenfasern und reduzierter Akkumulierung von extrazellulären Matrixproteinen.
Die Studie ermöglicht somit einerseits völlig neue Einblicke in die Genaktivität in Narbengewebe, und zeigte Wirkstoffe zur möglichen Therapie von hypertrophen Narben.
Wissenschaftliches Umfeld
Dr.in Vera Vorstandlechner begann 2017 ihr Doktoratsstudium bei Prof. Hendrik Jan Ankersmit, (Thoraxchirurgie) und Prof. Michael Mildner (Dermatologie). Im Rahmen der Forschung zu den regenerativen Eigenschaften vom Sekretom bestrahlter peripherer Monozyten („Aposec“) entstand ein umfassendes Projekt. Dieses setzte sich einerseits die genaue Charakterisierung von Hautfibroblasten und Mechanismen der hypertrophen Narbenbildung als auch der anti-fibrotischen Wirkung von Aposec in der Narbenbildung zum Ziel. Um diese Vorgänge im Detailuntersuchen zu können, machte sie sich die rasante Entwicklung der Einzelzellsequenzierung zu Nutze. Daraus entstand 2020 die erste Publikation zur Beschreibung von Fibroblasten-Populationen der gesunden Haut (2) und eine Kollaborationsarbeit als Ko-Erstautorin mit Prof. Patrick Brunner von der Universitätsklinik für Dermatologie (3). Aus diesen Arbeiten entstanden jeweils mehrere Folgeprojekte (4) und Diplomarbeiten. Zudem arbeitete Dr.in Vorstandlechner bereits während des Studiums an der Universitätsklinik für Plastische Chirurgie gemeinsam mit Priv. Doz. Alexandra Fochtmann-Frana an Studien zu Infektionen in Schwerstbrandverletzten und der Rehabilitation nach Verbrennungsverletzung (5, 6).
Die aktuelle Forschungsarbeit ist somit das zweite von drei Papers im Rahmen ihrer Dissertation. Die Projekte wurden durch eine Private-Public Partnership der Aposcience AG mit der Medizinischen Universität Wien sowie durch Förderungen der Forschungsförderungsgesellschaft (FFG) ermöglicht. Die dritte Arbeit zur Wirkung von Aposec in Narbenbildung soll kommendes Jahr publiziert werden und das PhD-Projekt vervollständigen.
Zur Person
Dr.in med. univ. Vera Vorstandlechner, geboren 1992, entdeckte während des Medizinstudiums (2011 bis 2017 in Wien) ihre Leidenschaft einerseits für die Plastische Chirurgie, andererseits für die Bench-to-Bedside-Forschung in der regenerativen Medizin. Nach Studienaufenthalten in Bern, Zürich (Schweiz) und Sydney (Australien) begann sie die wissenschaftliche Mitarbeit im Kollaborationslabor von Thoraxchirurg Hendrik Jan Ankersmit und dem dermatologischen Grundlagenforscher Michael Mildner. Im Zuge dessen konnte sie beide Interessen verbinden und entwickelte ein Dissertationsprojekt zur Forschung von Narbenbildung und Wirkstoffentwicklung zur Therapie von hypertrophen Narben. Für ihre Arbeiten wurde sie mit Vortragspreisen durch die DAV (Deutschsprachige Arbeitsgesellschaft für Verbrennungsmedizin) und die ÖGDV (Österreichische Gesellschaft für Dermatologie und Venerologie) und einem Stipendium der ÖGDV für einen Forschungsaufenthalt bei Prof. Michael Rendl an der Icahn School of Medicine (New York, USA) ausgezeichnet. Seit 2020 ist sie Assistenzärztin an der Universitätsklinik für Plastische und Rekonstruktive Chirurgie.
Ausgewählte Literatur
- Vorstandlechner V, Laggner M, Copic D, Klas K, Direder M, Chen Y, et al. The serine proteases dipeptidyl-peptidase 4 and urokinase are key molecules in human and mouse scar formation. Nature Communications. 2021;12(1):6242.
- Vorstandlechner V, Laggner M, Kalinina P, Haslik W, Radtke C, Shaw L, et al. Deciphering the functional heterogeneity of skin fibroblasts using single-cell RNA sequencing. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 2020.
- Rojahn TB, Vorstandlechner V, Krausgruber T, Bauer WM, Alkon N, Bangert C, et al. Single-cell transcriptomics combined with interstitial fluid proteomics defines cell type-specific immune regulation in atopic dermatitis. The Journal of allergy and clinical immunology. 2020;146(5):1056-69.
- Bangert C, Rindler K, Krausgruber T, Alkon N, Thaler FM, Kurz H, et al. Persistence of mature dendritic cells, T<sub>H</sub>2A, and Tc2 cells characterize clinically resolved atopic dermatitis under IL-4Rα blockade. Science immunology. 2021;6(55):eabe2749.
- Vorstandlechner V, Langthaler D, Ebenberger K, Pittermann A, Ihra G, Rath T, et al. Occupational reintegration after severe burn injury: a questionnaire study. 2021;133(11-12):625-9.
- Fochtmann-Frana A, Freystätter C, Vorstandlechner V, Barth A, Bolliger M, Presterl E, et al. Incidence of risk factors for bloodstream infections in patients with major burns receiving intensive care: A retrospective single-center cohort study. Burns : journal of the International Society for Burn Injuries. 2018;44(4):784-92.

(Wien, 23-06-2022) Aida Naghilou, PostDoc in der Arbeitsgruppe von Christine Radtke, Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie der MedUni Wien, wurde bei der 67. Jahrestagung des Plastic Surgery Research Councils in Toronto für die beste Kurzpräsentation (Quickshot-Präsentation) ausgezeichnet.
Die erfolgreiche Behandlung von peripheren Nervenverletzungen ist eine der größten Herausforderungen in der Medizin. Eine der Methoden zur chirurgischen Behandlung eines verletzten Nervs ist die Verwendung von Nervenconduits. Dabei handelt es sich um Röhren, die das Wachstum von Zellen und Nervenfasern unterstützen. Filamentmaterialien, wie z.B. Fasern, die innerhalb von Nervenconduits verwendet werden, tragen dazu bei, das Ergebnis der Regeneration zu verbessern.
Das Studienteam verwendet dazu Spinnenseide als ein von der Natur vorgegebenes Filamentmaterial in Nervenconduits. Die Schwann-Zellen, die ein wichtiger Teil des Nervenregenerationsprozesses sind, haften an der Spinnenseide und bewegen sich gezielt entlang der Spinnenseide. Obwohl diese Eigenschaften einzigartig sind, ist Spinnenseide immer noch ein natürliches Material mit begrenzter Verfügbarkeit. Für die Herstellung einer synthetischen Alternative müssen die Gründe für die Akzeptanz von Spinnenseide durch Schwann-Zellen geklärt werden.
In diesem interdisziplinären Projekt wollen die ForscherInnen herausfinden, welche Materialeigenschaften für den Erfolg von Spinnenseide bei der Nervenregeneration verantwortlich sind. Dazu verwenden sie Seiden von verschiedenen Spinnen, um zu untersuchen, ob sie die Schwann-Zellen in Zellkulturexperimenten unterstützen können. Darüber hinaus untersuchen sie die chemischen, mechanischen, strukturellen und morphologischen Eigenschaften der Spinnenseiden. So wird klar, welche Eigenschaften ein synthetisches Material für die medizinische Anwendung besitzen sollte. In diesem Projekt konnten Aida Naghilou und ihre KollegInnen zeigen, dass die Kristallinität und die Morphologie der Seide zwar keinen Einfluss auf die Adhäsion und Proliferation von Schwann-Zellen haben, dass aber die Proteinstruktur und die Steifigkeit der Seide für die Bewegung von Schwann-Zellen entscheidend sind und bei der Herstellung von synthetischen Materialien berücksichtigt werden müssen.
Diese Arbeit war eine Zusammenarbeit der MedUni Wien mit der Uni Wien, der BOKU und dem Europäischen Synchrotron (ESRF).
Zur Person
Aida Naghilou studierte in Teheran, Iran, Chemie und beendete das Masterstudium an der Universität Wien, wo sie auch promovierte und sich auf physikalische und Materialchemie konzentrierte. Nach ihrem PhD arbeitete sie als Senior Lecturer und begann dann 2019 an der MedUni Wien als PostDoc in der Gruppe von Christine Radtke in den Bereichen Tissue Engineering und Materialwissenschaften zu arbeiten. Sie ist Co-Autorin eines FWF-Projekts mit Radtke als Principal Investigator, das im Jahr 2020 angenommen wurde. Die ausgezeichnete Arbeit ist Teil dieses FWF-Projekts. Dies ist bereits ihr zweiter Preis vom PSRC, sie gewann den Best Non-PRS Article des Plastic Surgery Research Councils im September 2020 als Anerkennung für eine herausragende Publikation. Sie hat auch Preise vom European Materials Research Council und der Deutschen Bunsen-Gesellschaft für physikalische Chemie gewonnen.
Naghilou engagiert sich aktiv in der Wissenschaftskommunikation mit zahlreichen Vorträgen und Veranstaltungen bei z.B. Pint of Science, Wiener Schulen als young science Botschafterin, Dr. Hans Riegel Stiftung, Brain Awareness Week, und Lange Nacht der Forschung. Sie und ihre Gruppe posten regelmäßig Beiträge zur Wissenschaftskommunikation auf Instagram @spiders_and_nerves.
2022 Jänner - Mag.a Tamara Weiss, PhD und Dr.in Sabine Taschner-Mandl

Nach der Aktivierung werden Daten an YouTube übermittelt. Weitere Infos hier: Datenschutzerklärung
MedUni Wien RESEARCHER OF THE MONTH, Jänner 2022
Die Jury „Researcher of the Month” verleiht die Auszeichnung für diesen Monat Frau Mag.a Tamara Weiss, PhD und Frau Dr.in Sabine Taschner-Mandl aus Anlass der im Top-Journal „Nature Communications“ (IF 14,92) erschienenen Arbeit „Schwann cell plasticity regulates neuroblastic tumor cell differentiation via epidermal growth factor-like protein 8“. Die multidisziplinäre Studie entstand im Forschungslabor für Tumorbiologie der St. Anna Kinderkrebsforschung und wurde in Zusammenarbeit mit dem Institut für Analytische Chemie der Universität Wien, der Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie sowie der Universitätsklinik für Orthopädie und Unfallchirurgie der MedUni Wien realisiert.
Natürliche "Bremse" gegen bösartige Neuroblastome
Der menschliche Körper besteht aus hoch spezialisierten Komponenten. Knochen und Weichteilgewebe definieren die Form, Organe kümmern sich um den Blutkreislauf, die Verdauung und andere Funktionen, und Immunzellen bekämpfen Krankheitserreger [2]. Tatsächlich haben viele Zelltypen und Organe aber mehr als nur eine Rolle.
Neuroblastome sind die am häufigsten vorkommenden Tumore im Kindesalter. Es gibt gutartige und bösartige Formen, die sich vor allem in ihrer Zusammensetzung unterscheiden. Bösartige Neuroblastome bestehen aus neuroblastischen Tumorzellen, die sich unkontrolliert vermehren. Im Gegensatz dazu sind in gutartigen Neuroblastomen neben differenzierten Tumorzellen auch viele „Schwann-Zellen“ vorhanden. Schwann-Zellen kommen normalerweise nur in peripheren Nerven vor und ihre Aufgabe besteht darin, Axone zu isolieren oder nach einer Verletzung zu reparieren. Daher war das Ziel unserer Studie herauszufinden, welche Rolle die Schwann Zellen im Tumor spielen und ob sie die gutartige Tumorentwicklung beeinflussen.
Dazu wurden Neuroblastome und periphere Nerven mittels RNA-Sequenzierung analysiert und erstmals miteinander verglichen. Die Ergebnisse haben gezeigt, dass die Schwann-Zellen im gutartigen Neuroblastom den gleichen zellulären Status wie Schwann-Zellen nach einer Nervenverletzung aufweisen. Die Schwann-Zellen im Neuroblastom befinden sich also in einem speziellen ‚Reparaturmodus‘. Ähnlich wie nach einer Nervenverletzung könnten die Schwann-Zellen dadurch in der Lage sein, die neuronalen Tumorzellen zur Reifung anzuregen und ihr ungebremstes Wachstum zu stoppen. Um dies weiter zu untersuchen haben wir ein Ko-kultur Model entwickelt, in dem neuroblastische Tumorzellen entweder direkten oder nur indirekten Kontakt mit Schwann-Zellen im Reparaturmodus hatten. Die Schwann-Zellen waren in beiden Konditionen in der Lage die neuronale Differenzierung der Tumorzellen anzuregen und deren Wachstum einzubremsen. Die Suche nach Signalmolekülen, die von Schwann-Zell produziert werden und diesen Effekt vermitteln könnten, hat unsere Aufmerksamkeit auf das epidermale Wachstumsfaktor-ähnliche Protein 8 (EGFL8) gelenkt. Über dessen Funktion war bislang nichts bekannt. Wir konnten nachweisen, dass die Zugabe von EGFL8 ausreicht um die neuronale Differenzierung neuroblastischer Tumorzellen auszulösen. Zudem korreliert eine hohe Expression von EGFL8 in Neuroblastomen mit einem längeren Überleben von PatientInnen. Mittels der Phosphoproteomics-Methode konnten wir auch entschlüsseln welche Signalwege in Tumorzellen durch EGFL8 angeschaltet werden. Neben EGFL8 stellen diese nachgeschalteten Signalwege mögliche Angriffspunkte für zukünftige Behandlungsmethoden von Neuroblastomen dar.
Diese Studie hat EGFL8 als neuen, potenten Faktor identifiziert, der die neuronale Differenzierung stimuliert. EGFL8 könnte daher nicht nur für die Behandlung von Neuroblastomen, sondern auch von verletzten peripheren Nerven von Bedeutung sein.
Wissenschaftliches Umfeld
Diese Studie wurde durch eine lang bestehende, enge und interdisziplinäre Zusammenarbeit von WissenschafterInnen der St. Anna Kinderkrebsforschung, der Medizinischen Universität Wien und der Universität Wien ermöglicht. Die Tumorproben und Zelllinien stammen aus der Biobank der St. Anna Kinderkrebsforschung, die humanen peripheren Nerven stammen von einer Kooperation mit Herrn Univ.-Prof Dr. Reinhard Windhager, Leiter der Universitätsklinik für Orthopädie und Unfallchirurgie. Die Proteom- und Phosphoproteom-Experimente wurden vom Team um Univ.-Prof. Dr. Christopher Gerner der Universität Wien durchgeführt. Der überwiegende Teil der Experimente wurde an der St. Anna Kinderkrebsforschung im Rahmen der Doktorarbeit von Tamara Weiss im Forschungslabor von Assoc.-Prof. Peter F. Ambros durchgeführt. Sabine Taschner-Mandl hat diese Studie maßgeblich designt und die funktionellen Analysemethoden entwickelt. Die Publikation zur Studie wurde in enger Zusammenarbeit der Forscherinnen 2020 finalisiert und die gewonnenen Erkenntnisse sind bereits in neue Forschungsprojekte eingeflossen. Daher besteht die Kooperation zwischen der Medizinischen Universität Wien, der St. Anna Kinderkrebsforschung und der Universität Wien bis heute und ermöglicht es seltene Proben von periphere Nerven und Tumoren mit höchstmodernen Methoden zu analysieren und miteinander zu vergleichen um deren Funktion und Aufgaben besser zu verstehen. Die Ähnlichkeiten zwischen regenerativen und pathologischen Prozessen in neuralem Gewebe sind erstaunlich. Das Ziel ist die zugrundeliegenden molekularen Mechanismen zu nutzen und neue Therapien für verletze Nerven und Neuroblastome zu entwickeln.
Zu den Personen
Mag.a Tamara Weiss, PhD, studierte Molekulare Biologie an der Universität Wien und hat für ihre Diplomarbeit als Gastwissenschaftlerin im Anne McLaren Labor für regenerative Medizin am MRC Cambridge Stem Cell Institute der Universität von Cambridge geforscht. Anschließend studierte sie an der Medizinischen Universität Wien im PhD Programm N094 mit dem Schwerpunkt ‚Maligne Erkrankungen‘, das sie 2017 mit Auszeichnung abschloss. Seit 2018 ist Tamara Weiss Postdoc und Laborleiterin des Forschungslabors der Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie an der Medizinischen Universität Wien. Dort lehrt sie im Diplomstudium Humanmedizin und in diversen PhD Programmen. Ihre Forschung ist umfassenden Charakterisierung von humanen Schwann-Zellen gewidmet um deren Rolle in der Regeneration und in Pathologien peripherer Nerven, sowie in unterschiedlichen Tumoren zu untersuchen.
Dr.in Sabine Taschner-Mandl hat ihr Doktoratstudium an der Medizinischen Universität Wien mit dem Schwerpunkt ‚Immunologie‘ mit Auszeichnung abgeschlossen. Es folgte eine Postdoc Anstellung an der St. Anna Kinderkrebsforschung und ein Aufenthalt Taschner-Mandls als Gastwissenschaftlerin bei Significo und der University of Helsinki im Rahmen des EC-FP7-Marie-Curie-Programms. Seit 2018 ist Sabine Taschner-Mandl Gruppenleiterin der Forschungsgruppe für Tumorbiologie und ihre wissenschaftlichen Leistungen wurden bereits mit hochdotierten Grants (FWF, WWTF, FFG, EC H2020) ausgezeichnet. Zusätzlich übt sie Lehrtätigkeiten an der Medizinischen Universität Wien sowie der Technischen Universität Wien aus. Der Fokus ihres Forschungslabors liegt in der Erforschung von Mechanismen der Krebsentstehung und Metastasierung, der Entwicklung neuer diagnostischer Verfahren und therapeutischen Ansätzen für Neuroblastome und andere pädiatrische Krebserkrankungen, um zukünftig Kindern mit malignen Tumoren präzisere Behandlungsmöglichkeiten bieten zu können.
Ausgewählte Literatur
- Schwann cell plasticity regulates neuroblastic tumor cell differentiation via epidermal growth factor-like protein 8. Weiss T, Taschner-Mandl S, Janker L, Bileck A, Rifatbegovic F, Kromp F, Sorger H, Kauer MO, Frech C, Windhager R, Gerner C, Ambros PF, Ambros IM. (2021) NATURE COMMUNICATIONS, 2021 Mar 12;12(1):1624. doi: 10.1038/s41467-021-21859-0. PMID: 33712610; PMCID: PMC7954855.
- Landscape of Bone Marrow Metastasis in Human Neuroblastoma Unraveled by Transcriptomics and Deep Multiplex Imaging. Lazic D, Kromp F, Rifatbegovic F, Repiscak P, Kirr M, Mivalt F, Halbritter F, Bernkopf M, Bileck A, Ussowicz M, Ambros I M, Ambros, P F, Gerner C, Ladenstein R, Ostalecki C, Taschner-Mandl S. (2021) Cancers. 13(17):4311. https://doi.org/10.3390/cancers13174311
- Multimodal analysis of cell-free DNA whole-genome sequencing for pediatric cancers with low mutational burden. Peneder P, Stütz A M, Surdez D, Krumbholz M, Semper S, Chicard M, Sheffield N C, Pierron G, Lapouble E, Tötzl M, Ergüner B, Barreca D, Rendeiro A F, Agaimy A, Boztug H, Engstler G, Dworzak M, Bernkopf M, Taschner-Mandl S, Ambros I M, Myklebost O, Marec-Bérard P, Burchill S A, Brennan B, Strauss S J, Whelan J, Schleiermacher G, Schaefer C, Dirksen U, Hutter C, Boye K, Ambros P F, Delattre O, Metzler M, Bock C, Tomazou E M. (2021) NATURE COMMUNICATIONS, May 28;12(1):3230. doi: 10.1038/s41467-021-23445-w.
- Defining the regenerative effects of native spider silk fibers on primary Schwann cells, sensory neurons, and nerve-associated fibroblasts. Millesi F, Weiss T, Mann A, Haertinger M, Semmler L, Supper P, Pils D, Naghilou A, Radtke C. (2020) FASEB J. doi: 10.1096/fj.202001447R. Epub 2020 Nov 19. PMID: 33210360.
- An annotated fluorescence image dataset for training nuclear segmentation methods. Kromp F, Bozsaky E, Rifatbegovic F, Fischer L, Ambros M, Berneder M, Weiss T, Lazic D, Dörr W, Hanbury A, Beiske K, Ambros P F, Ambros I M & Taschner-Mandl S (2020). NATURE SCIENTIFIC DATA, 7(1), 262. https://doi.org/10.1038/s41597-020-00608-w
- Assessment of Pre-Analytical Sample Handling Conditions for Comprehensive Liquid Biopsy Analysis. Gerber T, Taschner-Mandl S, Saloberger-Sindhoringer L, Popitsch N, Heitzer E, Witt V, Geyeregger R, Hutter C, Schwentner R, Ambros I A, and Ambros P F (2020) J Mol Diagn. https://doi.org/10.1016/j.jmoldx.2020.05.006
- Automated image analysis of stained cytospins to quantify Schwann cell purity and proliferation. Weiss T, Semmler L, Millesi F, Mann A, Haertinger M, Salzmann M, Radtke C. (2020) PLOS ONE, May 22;15(5):e0233647. doi: 10.1371/journal.pone.0233647.
- Adipose Stem Cell-Derived Extracellular Vesicles Induce Proliferation of Schwann Cells via Internalization. Haertinger M, Weiss T, Mann A, Tabi A, Brandel V, Radtke C. (2020) CELLS. Jan 9;9(1). pii: E163.
- Metronomic topotecan impedes tumor growth of MYCN-amplified neuroblastoma cells in vitro and in vivo by therapy induced senescence. Taschner-Mandl S, Schwarz M, Blaha J, Kauer M, Kromp F, Frank N, Rifatbegovic F, Weiss T, Ladenstein R, Hohenegger M, Ambros IM, Ambros PF. (2016) ONCOTARGET, 7: 3571-3586
- Proteomics and transcriptomics of peripheral nerve tissue and cells unravel new aspects of the human Schwann cell repair phenotype. Weiss T, Taschner-Mandl S, Bileck A, Slany A, Kromp F, Rifatbegovic F, Frech C, Windhager R, Kitzinger H, Tzou CH, Ambros PF, Gerner C, Ambros IM. (2016) GLIA, 64: 2133-2153
Zwei FWF-Grants innerhalb eines Jahres für Forschungsprojekte der MedUni Wien zur Nervenregeneration mit Spinnenseide
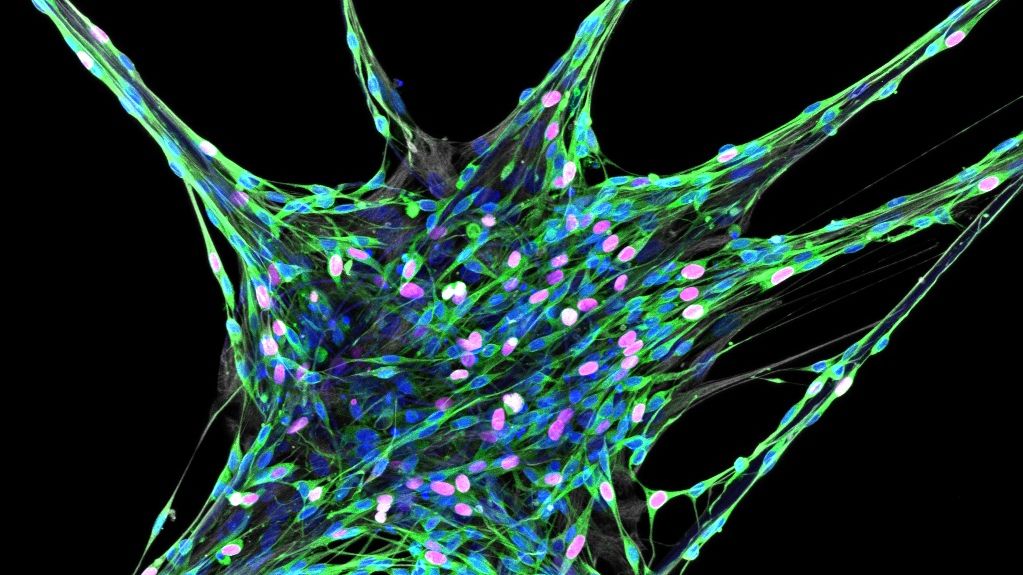
(Wien, 11-10-2021) Das Forschungsteam rund um Christine Radtke von der Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie der Medizinischen Universität Wien erhält für seine Forschungsprojekte zum Thema Nervenregeneration mit Spinnenseide zwei Grants vom Österreichischen Wissenschaftsfonds (FWF) innerhalb eines Jahres. In diesen Projekten untersuchen die ForscherInnen die verschiedenen Eigenschaften von Spinnenseiden und ob sich Spinnenseide und Hydro-Gele als Materialien für Füllungen von synthetischen Nervenleitungen (Conduits) eignen.
Die Regeneration von verletzten Nerven ist eine der größten Hürden in der rekonstruktiven Chirurgie. Trotz kontinuierlicher Bemühungen zur Verbesserung der Genesung beeinträchtigen Komplikationen und/oder Folgeoperationen die Lebensqualität der PatientInnen stark. Eine der Methoden zur chirurgischen Behandlung eines verletzten Nervs ohne Transplantation ist die Verwendung von künstlichen Nervenleitungen, den Conduits. Dabei handelt es sich um Röhrchen, die an beide Teile des verletzten Nervs genäht werden und das Wachstum von Zellen und Nervenfasern unterstützen. Sie bieten eine Leitstruktur für die Regeneration von Axonen und umgehen gleichzeitig die Nachteile, die bei einer Transplantation durch die Gewinnung von körpereigenem Material entstehen. Die hohlen Conduits haben jedoch ihre Grenzen, da sie bei größeren Nervenverletzungen von mehr als drei Zentimetern bisher keine erfolgreiche Regeneration ermöglichen. Christine Radtke und ihre KollegInnen untersuchen nun Spinnenseidenfasern als vielversprechendes Füllmaterial für synthetische Conduits, um auch größere Nervenverletzungen zu behandeln.
Spinnenfäden vernetzen verletzte Nerven
Das Team rund um Christine Radtke forscht bereits seit mehreren Jahren am Einsatz von Spinnenseide in der Nervenregeneration. Spinnenfäden haben unvergleichliche Eigenschaften wie hohe Elastizität und Festigkeit sowie eine gute Wärmebeständigkeit und Biokompatibilität. Bei der Verwendung in Nervenconduits haften zudem die Schwann-Zellen, die ein wichtiger Teil des Nervenregenerationsprozesses sind, an der Spinnenseide und bewegen sich gezielt entlang der Fasern. Da es sich bei Spinnenseide um ein natürliches Material mit begrenzter Verfügbarkeit handelt, untersucht das Team von Radtke in einem der beiden vom FWF geförderten Projekte die Materialeigenschaften der Fasern, um herauszufinden, welche Eigenschaften ein synthetisches Material für die medizinische Anwendung besitzen sollte. Dafür werden Seiden von verschiedenen Spinnenarten nach chemischen, mechanischen, strukturellen und morphologischen Eigenschaften untersucht, sowohl im trockenen als auch im nassen Zustand der Fasern.
Im zweiten Forschungsvorhaben wird Spinnenseide gemeinsam mit anderen Materialien als Füllung für Nervenconduits erforscht. Im Tiermodell konnte gezeigt werden, dass Spinnenseidenfasern als Füllmaterial in Venentransplantaten einen Nervenschaden über die kritische Länge von sechs Zentimetern erfolgreich reparieren. „Der nächste Schritt besteht darin, die Venentransplantate durch gefüllte synthetische Conduits zu ersetzen. Wir füllen dafür die Conduits mit Spinnenseiden und Hydro-Gelen, von denen wir annehmen, dass sie in ihrer Kombination ideale Voraussetzungen für eine Nervenregeneration bieten“, erklärt Christine Radtke das aktuelle Projekt. Während die Seide als Leitstruktur für die Regeneration von Axonen fungiert, bieten Hydro-Gele eine dreidimensionale Matrix, die das Gewebe imitiert und strukturelle Integrität verleiht und somit den Kollaps langer Leitungen verhindert. „Wir nehmen an, dass in Hydro-Gel eingebettete Spinnenseidenfasern das Potenzial haben, künstliche Conduits so zu verbessern, dass sie eine gleichwertige Alternative zum Nerventransplantat für lange Nervenverletzungen werden“, so Radtke.
Die beiden Projekte „Das ideale Conduit in der peripheren Nervenregeneration“ und „Warum mögen Schwann-Zellen Spinnenseide“ werden bis 2024 vom FWF gefördert. Neben Klinikleiterin Christine Radtke als Projektleiterin arbeiten Helga Lichtenegger, Aida Naghilou, Lorenz Semmler und Flavia Millesi an den Forschungsprojekten. Helga Lichtenegger ist Expertin für Biomaterialien und Techniken zur strukturellen und mechanischen Charakterisierung. Aida Naghilou bringt ihre umfassende Erfahrung in Spektroskopie, Optik und Zellkulturstudien zur Nervenregeneration in das Projekt ein. Lorenz Semmler ist Spezialist für die Bewertung verschiedener funktioneller Outcome-Parameter in Tiermodellen und Flavia Millesi etablierte mehrfarbige Immunfluoreszenzpanels sowie Migrationsassays, die eine detaillierte Beurteilung der Zellcharakteristik von Spinnenseiden erlauben.

Stefan Hacker erhält Theodor-Billroth Preis
Dr.med.univ. Stefan HACKER erhält im Rahmen des 58. Österreichischen Chirurgenkongress den Theodor-Billroth Preis für seine in "Scientific Reports" erschiene Arbeit "Paracrine Factors from Irradiated Peripheral Blood Mononuclear Cells Improve Skin Regeneration and Angiogenesis in a Porcine Burn Model".
Wir gratulieren ganz herzlich!

Eva Györi erhält Wilhelm-Auerswald Preis der Gesellschaft der Ärzte
Dr.med.univ. Eva GYÖRI, PhD, geboren PLACHETA, erhält den Wilhelm-Auerswald Preis für die beste schriftliche Doktorarbeit, sowie den 2.Gesamtpreis bei der diesjährigen Prämierung der besten Doktorarbeiten, welche an einer österreichischen Medizinischen Universität verfasst wurden. Ihre Arbeit "Enhancing cross-face nerve grafts with regional sensory nerves" entstand an der Medizinischen Universität Wien im PhD Programm "Clinical Neurosciences" und wurde von Em. Univ. Prof. Dr. Manfred FREY und Univ. Prof. Dr. Johannes HAINFELLNER betreut.
Wir gratulieren ganz herzlich!
Den Verbrennungs Newsletter vom März 2017 finden Sie hier
Prävention von Brandverletzungen in der Adventzeit
Die Adventzeit hat für viele Menschen eine besondere Bedeutung. Oftmals ist es eine Zeit, in der wir bewusst versuchen, den Alltag ein wenig zu entschleunigen, mehr Zeit zu Hause verbringen, uns auf Weihnachten einstimmen und es uns daheim mit Tee, Keksen, Kerzen gemütlich machen.
Andererseits bedeutet die Vorweihnachtszeit aber auch Stress. Geschenke müssen besorgt werden, die Besuche erledigt und gefühlte unzählige Verpflichtungen erfüllt werden.
Wie die Adventzeit empfunden wird, ist etwas sehr Individuelles. Für uns, die wir als Team des Zentrums für Schwerbrandverletzte des Allgemeinen Krankenhauses Wien arbeiten, bedeutet die Weihnachtszeit vor allem eines: das Wissen das jedes Jahr rund um Weihnachten Menschen mit Verbrennungen zu uns kommen. Verbrennungen, die viel Schmerz und Leid für den Patienten und seine Angehörigen bedeuten. Und Verbrennungen, die oftmals verhindert werden hätten können.
Auch wenn Sie die folgenden Tipps wahrscheinlich schon oft gehört haben, möchten wir sie Ihnen nochmal ins Gedächtnis rufen. Besser einmal eine Vorsichtsmaßnahme zu viel als zu wenig.
Eine Brandverletzung passiert in Sekundenbruchteilen – mit den Folgen leben Sie für den Rest Ihres Lebens.
- Adventkränze: trockene Nadeln, Schleifen, Bänder, Strohsterne etc. sind extrem leicht entflammbar. Lassen Sie einen Adventkranz, an dem Kerzen brennen NIE aus den Augen.
- Kerzen: Kerzen können umkippen oder umstehende Gegenstände entzünden. Verlassen Sie NIE einen Raum ohne sicherzustellen, dass keine Kerzen mehr brennen.
- Christbäume: Kerzen und Sprühkerzen auf Christbäumen stellen genau so eine Gefahr da. Entweder verwenden Sie elektrische Kerzen für Ihren Christbaum oder lassen Sie die Kerzen nie unbeaufsichtigt. Haben Sie zur Sicherheit einen Kübel WASSER neben dem Christbaum stehen. Achten Sie darauf, dass der Christbaum sicher steht und sich nicht in der Nähe von Vorhängen, Tischtüchern oder anderen brennbaren Gegenständen befindet.
- Brennflüssigkeiten: Brennbare Flüssigkeiten wie sie sich zum Beispiel in Zimmeröfen oder in Fonduepasten befinden stellen eine ebenso große Gefahr dar. Hier muss immer mit äußerster Vorsicht und genügend Sicherheitsabstand zu anderen Personen hantiert werden.
- Kochen: Zu lange sehr heiß erhitztes Fett kann sich entzünden. Löschen Sie einen solchen Fettbrand niemals mit Wasser, sondern mit einer Löschdecke oder einem Feuerlöscher, den Sie in der Küche griffbereit haben
- Kinder: mit Kindern im Haushalt ist es besonders wichtig, all diese Sicherheitsmaßnahmen nicht nur selbst zu beachten, sondern sie (größeren) Kindern ebenfalls zu erklären und sie auf die Gefahren hinzuweisen. Lassen Sie niemals Streichhölzer oder Feuerzeuge herumliegen und lassen Sie die Kinder nicht alleine in der Nähe von Kerzen.
Sollte doch einmal etwas passieren:
- Verlassen Sie den Gefahrenbereich
- Rufen Sie die Rettung 144 und die Feuerwehr 122
- Kühlen Sie die Verbrennung mit kühlem, nicht kaltem, Wasser
Schwerwiegende, tiefe Verbrennungen müssen immer von einem mit Brandverletzungen erfahrenen Arzt behandelt werden.
Die Intensivstation für Schwerbrandverletzte des AKH Wien erreichen Sie über das 24h Notfalltelefon unter +43 (0)1 40400 - 68600.
Besuchen Sie auch die Homepage der von uns unterstützten Selbsthilfegruppe „Phönix“, die sich für Menschen mit Brandverletzungen einsetzt: www.selbsthilfephoenix.at
Neue Leiterin für die Klinische Abteilung für Plastische und Rekonstruktive Chirurgie
Wir freuen uns mit Oktober 2016 unsere neue Klinikleiterin Frau Univ. Prof. Dr.med.Christine Radtke, MBA, FEBOPRAS willkommen zu heißen.
Frau Professor Radtke war zuvor leitende Oberärztin an der Medizinischen Hochschule Hannover, an der sie auch, neben der Yale University (USA), ihre medizinische Ausbildung genoss. Ihre wissenschaftlichen Schwerpunkte liegen auf der peripheren Nervenchirurgie und Nervenrekonstruktion, dem Tissue Engineering und der Entwicklung neuer Therapieoptionen bei malignen Weichteilerkrankungen. Forschungsaufenthalte verbrachte sie an der Yale University (USA) und der Harvard Medical School (USA). Ihre wissenschaftlichen Leistungen wurden bereits mehrfach mit renommierten internationalen Preisen ausgezeichnet.
